Оптимізація детоксикаційної терапії у хворих на гострі кишкові інфекції
16.08.19д.мед.н, проф. Малий В.П.1,
к.мед.н. Асоян І.М.1,Танчук Ю.В.2,
д.мед.н, проф. Нартов П.В.1,2,
к.мед.н. Маслова В.С.2
1 – Харківська медична академія післядипломної освіти
2 – КНП ХОР «Обласна клінічна інфекційна лікарня»
Вступ
Гострі кишкові інфекції (ГКІ) представляють одну з найбільш актуальних проблем охорони здоров’я у світі (ВООЗ сповіщає про щорічну реєстрацію діарейних захворювань у кількості більше 1 млрд.), що завдає значних соціально-економічних збитків [1, 2]. У даний час відбувається зміна етіологічних чинників ГКІ. Так, етіологічними чинниками зазначених інфекцій частіше всього являються віруси хоча в Україні до теперішнього часу не втратили своєї значущості бактеріальні ГКІ (шигели, патогенні ешерихії, сальмонели, єрсинії тощо), а також умовно-патогенна мікрофлора (УПМ) [3, 4]. Захворювання мають широкий діапазон клінічних проявів ̶ від легких кишкових дисфункцій до важких форм з можливою генералізацією інфекції. Від своєчасності та адекватності призначення терапії при ГКІ залежать їх тривалість захворювання і наслідки [5].
За сучасними уявленнями, терапія зазначених інфекцій повинна бути комплексною і етапною з індивідуальним підходом до вибору препаратів з розшифруванням етіології, тяжкості, фази і клінічної форми хвороби та стану макроорганізму до моменту захворювання [6]. З огляду на зростання лікарської резистентності збудників до широко застосовуваних антибактеріальних препаратів, а також обмеження щодо їх призначення, одним із методів етіопатогенетичної терапії діарей являється ентеросорбція [7]. Етіологічним чинником ГКІ в економічно розвинених країнах до 75–80% усіх верифікованих випадків є вірусні агенти (Koch J. et al., 2006; Kittigul L. et al., 2009; Bhattacharya S.K. et al., 2012), тому застосування ентеросорбентів вважають обгрунтованим завдяки здатності фіксувати на своїй поверхні бактерії та віруси, що знаходяться в порожнині кишечника і таким чином перешкоджати генералізації інфекційного процесу не тільки бактеріальної а й вірусної етіології [15].
У численних клінічних дослідженнях встановлено, що при ГКІ, у патогенезі яких особливе значення мають адгезія, цитотоксична дія збудників і ендотоксикоз, ентеросорбенти, на відміну від антибактеріальних препаратів, надають швидкий і виражений детоксикаційний, гіпотермічний і антидіарейний клінічний ефект. При цьому за рахунок сорбції й елімінації з кишечника конкурентної патогенної і УПМ ентеросорбенти негативно не впливають на мікробіоценоз кишечника [8]. Одним із існуючих і зареєстрованих в Україні препаратів зазначеної дії є Ентероклін, який відповідає критеріям «ідеального» сорбенту за рахунок наявності у своєму складі високодисперсного діоксиду кремнію, пектину, хітозану та лактулози. Ентероклін володіє наступним спектром позитивних ефектів [13, 14, 15]:
- має високу ефективність завдяки великій площі активної поверхні та виводить з організму токсини, йони важких металів;
- адсорбує мікроорганізми та гальмує розвиток хвороботворної мікрофлори завдяки діоксиду кремнію у складі;
- сприяє підтримці нормальної мікрофлори;
- є безпечним, без травматичної дії на слизову оболонку ШКТ завдяки пектину у складі;
- відсутній ризик закрепу завдяки пектину і лактулозі;
- знижує кислотність шлункового соку, відновлює слизову оболонку шлунку завдяки хітозану у складі;
- перешкоджає втраті вітамінів і мінералів;
- стимулює неспецифічний імунітет;
- має нейтральний смак, без смакових та ароматичних добавок;
- має зручну форму випуску та дозування.
Метою роботи було вивчення ефективності ентеросорбенту Ентероклін в комплексній терапії ГКІ.
Матеріали та методи
Дослідження виконувалось на клінічній базі кафедри інфекційних хвороб Харківської медичної академії післядипломної освіти КНП ХОР «Обласна клінічна інфекційна лікарня».
Нами було обстежено включено 37 пацієнтів з ГКІ, із них 15 випадково відібраних отримували терапію без призначення Ентерокліну (група порівняння), а 22 – додатково одержували зазначений ентеросорбент (основна група) у дозі 1 пакет-саше 3 рази на добу протягом 5 днів. Хворі були обстежені в динаміці − до та після лікування (рис. 1).
Дизайн дослідження
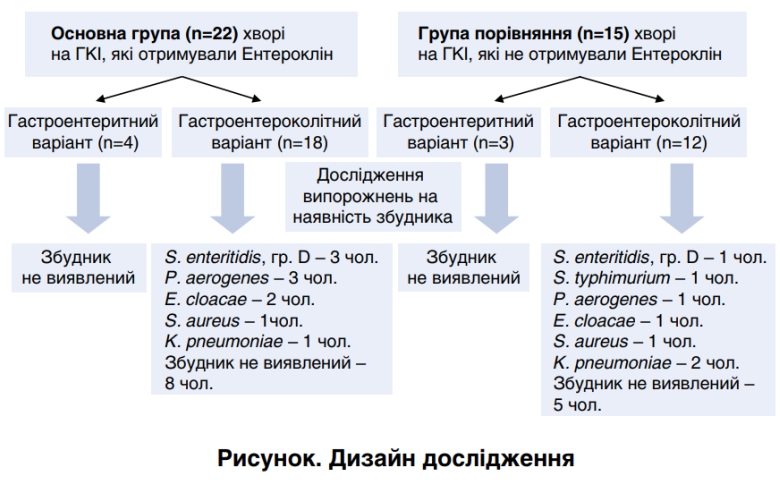
В основній групі хворих гастроентеритний варіант ГКІ реєструвався у 18,2%, а гастроентероколітний – у 81,8%. У групі порівняння гастроентеритний варіант захворювання виявлявся у 26,6%, а гастроентероколітний у 73,4%.
Серед основної хворих групи чоловіків було 9 (40,9%), а жінок 13 (59,1%). У групі порівняння осіб чоловічої статі було 6 (40%), а жінок 8 (60%). Середній вік хворих основної групи становив 34,6 років, а групи порівняння ̶ 36,7років.
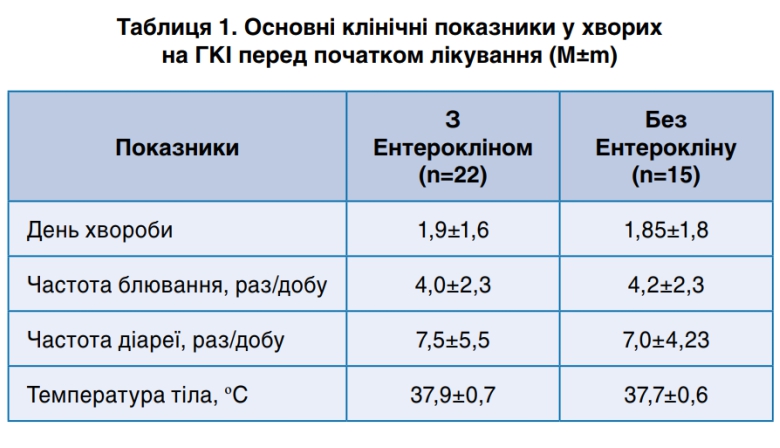
Дані, що згруповані в табл. 1 свідчать про те, що за основними клінічними показниками при надходженні до стаціонару хворі у групах достовірно не відрізнялися.
Клінічне обстеження хворих включало вивчення скарг, анамнезу життя та захворювання, результатів об’єктивного обстеження, лабораторних даних (загальний аналіз крові та сечі), біохімічні дослідження крові відповідно клінічного стану пацієнта та показань, визначення малонового діальдегіду.
Статистична обробка отриманих результатів досліджень здійснювалася за допомогою програми STATISTIKA for Windows (StatSoftInc, США).
Результати та обговорення
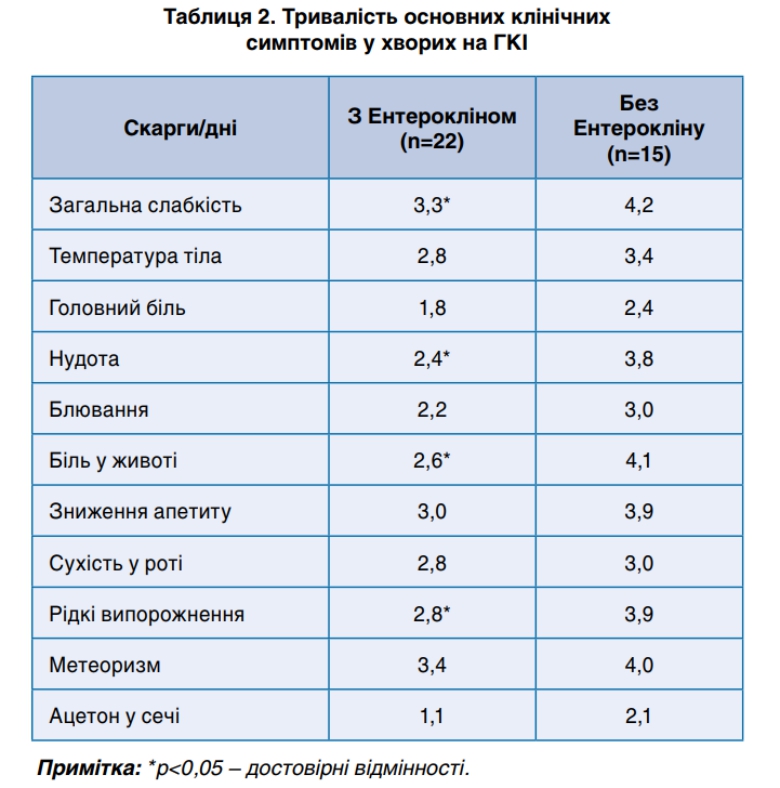
У нашому дослідженні було виявлено, що включення Ентерокліну в стандартну терапію ГКІ суттєво вплинуло на перебіг захворювання, зокрема призвело до достовірного скорочення тривалості основних клінічних симптомів (табл. 2): загальна слабкість у середньому на 27,3% (р<0,05), нудота − на 58,3% (р<0,05), біль у животі − на 57,7% (р<0,05), рідкий стілець − на 39,3% (р<0,05) у порівнянні з пацієнтами, яким не призначався Ентероклін. У підсумку симптоми інтоксикації, локальних проявів хвороби, формування нормального стільця відбувалося статистично скоріше, ніж у пацієнтів контрольної групи. І, як наслідок, в основній групі хворих спостерігалося статистично значиме (р<0,05) зменшення на 30,0% (2,1 дні) тривалості перебування у стаціонарі по відношенню до таких у порівняльній групі.
Крім того, у пацієнтів, яким призначався Ентероклін спостерігалось достовірне скорочення тривалості кетонурії на 90,9% (р<0,05) ніж у хворих контрольної групи. Виявлення ацетону в сечі у хворих на ГКІ свідчить про наявність ацетонемічного синдрому, адже в таких пацієнтів останній є досить поширеним явищем через блювоту і відсутність прийому їжі. У результаті цього активується ліполіз, підвищується в крові рівень вільних жирних кислот з подальшою їх метаболізацією в ацетилкоензим А у циклі трикарбонових кислот Кребса, з синтезом кетонових тіл (ацетону, ацетооцтової і β-оксимасляної кислот), знижується активність глюкозо-6-фосфатази у печінці. Разом з тим, на тлі інфекції виникає цитопатична дія збудника на ентероцит з розвитком вторинної лактазної недостатності та діареї осмотичного типу з накопиченням великої кількості летючих коротко ланцюгових жирних кислот, водню, вуглекислого газу і негідролізованних вуглеводів. Це призводить до активації споживання глюкози з подальшим зниженням її концентрації в крові, що і сприяє розвитку метаболічного ацидозу і ацетонемії. Утворені кетонові тіла окислюються в м’язах, міокарді, головному мозку до вуглекислого газу і води, підвищується рівень лактату і сечової кислоти. Через розвиток кетоацидозу спостерігається токсична дія недоокислених продуктів метаболізму на ЦНС призводить до вегетативних розладів, які реєструвались у хворих (пітливість, тахікардія, тахіпноє, лихоманка), а іноді до блювоти, болю у животі спастичного характеру тощо [9, 10]. Тому призначення ентеросорбенту Ентерокліну призвело до зниження ендогенної інтоксикації, зокрема за рахунок кетонових тіл, що сприяло зменшенню їх негативної дії на організм.
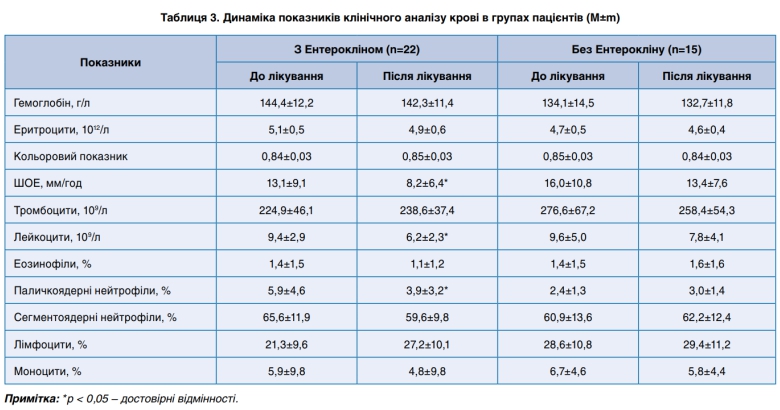
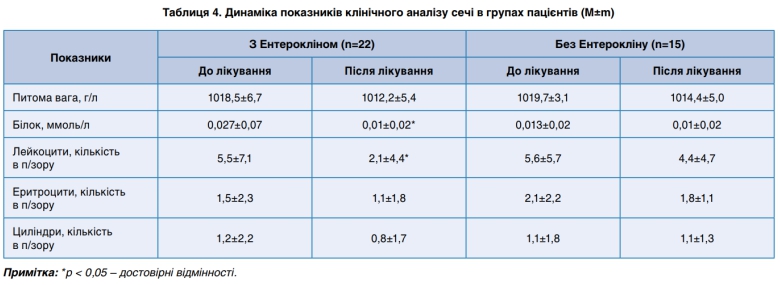
У пацієнтів, яким призначався Ентероклін, також спостерігалась більш рання нормалізація показників клінічного аналізу крові (табл. 3), зокрема ШОЕ на 59,8% (р<0,05), кількості лейкоцитів – на 51,6% (р<0,05) та паличкоядерних нейтрофілів– на 51,3% (р<0,05) у порівнянні з такими у хворих, які отримували терапію без Ентерокліну, що свідчило про більш раніше згасання патологічного процесу в організмі.
Терапія Ентерокліном також сприяла суттєвому зменшенню вмісту білка та лейкоцитів у клінічному аналізі сечі (табл. 4). Включення препарату сприяло покращенню функції нирок за рахунок сорбції токсинів та зменшення їх впливу на ниркову тканину.
Важливо зазначити, що не згасає відношення клініцистів до інформативності такого важливого дослідження показника як перекисного окислення ліпідів (ПОЛ), як механізму, що грає велику роль у патогенезі ГКІ. Відомо, що пусковим механізмом у розвитку синдрому інтоксикації є бактеріальні ліпополісахариди (ЛПС) – ендотоксини грамнегативних мікроорганізмів, а також продукти вторинного ендотоксикозу, що утворюються в організмі внаслідок токсинної агресії ззовні і здатні пролонгувати й обтяжувати інтоксикацію. Вплив ЛПС бактерій на активацію процесів ПОЛ активує простагландиновий каскад, паралельно інтенсифікує вільно-радикальне окислення, продукти якого мають пряму цитотоксичну дію, пошкоджують клітинні мембрани, тим самим знову активізують вивільнення субстрату для біосинтезу простагландинів. У зв’язку з цим, вивчення стану антиоксидантної систем у хворих на ГКІ викликає безсумнівний інтерес у плані поглиблення уявлень про патогенез, показання до призначення патогенетичної терапії, як критерій реконвалесценції. Як показник активності прооксидантної системи найбільш відомий малоновий діальдегід, який накопичується у крові й викликає синдром інтоксикації та використовується для прогнозу і контролю лікування [11, 12].
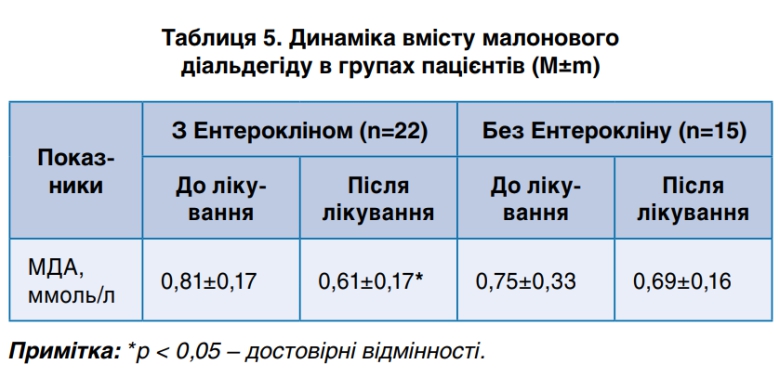
При призначенні Ентерокліну спостерігалось статистично значиме зниження рівня малонового діальдегіду на 32,8% (р<0,05) у порівнянні з такими в контрольній групі (табл. 5). Детоксикаційна терапія Ентерокліном призвела до суттєвого зниження інтенсивності ПОЛ, зменшення оксидативного стресу в організмі та купіювання інфекційного процесу.
Висновки
- При виборі ентеросорбенту для лікування ГКІ необхідно враховувати їх сорбційну ємкість, швидкість поглинання токсичних сполук, селективність сорбції, а також наявність побічних явищ.
- Ентеросорбент Ентероклін являється засобом із багатогранною ефективністю, що визначається детоксикуючою, антидіарейною і, можливо, етіотропною дією завдяки унікальному складу компонентів з сорбційною активністю. Включення препарату в комплексну терапію призводить до достовірного скорочення тривалості загальної слабкості, нудоти, болю у животі, рідкого стільця та кетонурії.
- Лікування Ентерокліном пришвидшило нормалізацію картини крові та сечі.
- Застосування Ентерокліну приводило до зниження рівня малонового діальдегіду в динаміці у порівнянні з показниками контрольної групи, що свідчило про зниження кількості проміжних продуктів ПОЛ, інтенсивності оксидативного стресу та зменшення ендогенної інтоксикації в процесі лікування.
- Тривалість перебування хворих у стаціонарі при застосуванні ентеросорбенту Ентероклін зменшилось на 30,0% (р<0,05).
- Ентероклін може використовуватися як важливий високоефективний компонент терапії гострих кишкових інфекцій, як бактеріальної, так і вірусної етіології, незалежно від тяжкості хвороби, а також від типу діареї.
Література
- Acree M. Acute Diarrheal Infections in Adults / М. Acree, A. M. Davis // Jama. – 2017. – Т. 318. – №. 10. – С. 957-958.
- Riddle M. S. ACG clinical guideline: diagnosis, treatment, and prevention of acute diarrheal infections in adults / M. S. Riddle, H. L. DuPont, B. A. Connor // The American journal of gastroenterology. – 2016. – Т. 111. – №. 5. – С. 602.
- Малиш Н.Г. Шляхи оптимізації епідеміологічного нагляду за гострими кишковими інфекціями в Україні / Н.Г. Малиш, М.Д. Чемич, О.В. Кузьменко // Східноукраїнський медичний журнал. – 2019. – Т. 7, № 1. – С. 28-38.
- Трихліб В. І. Спалахи інфекційних захворювань у країнах світу, обумовлені вживанням харчових продуктів / В. І. Трихліб // Актуальная инфектология. – 2018. – Т. 6, № 5. – С. 16-23.
- Інфекційні хвороби : підручник : у 2 т. / за ред. В. П. Малого, М. А. Андрейчина. – Львів : «Магнолія», 2018. – Т. 1. – 652 с.
- Голубовская О. А. Современные подходы к диагностике и лечению диарейных заболеваний / О. А. Голубовская // Семейная медицина. – 2015. – №. 3. – С. 35-40.
- Бородин Ю. И. Биологические свойства сорбентов и перспективы их применения / Ю. И. Бородин, В. И. Коненков, В. Н. Пармон [и др.] // Успехи современной биологии. – 2014. – Т. 134. – № 3. – С. 236–248.
- Малый В. П. Острые кишечные инфекции с диарейным синдромом / В.П. Малый // Епідеміологія, гігієна, інфекційні хвороби. – 2018. – № 1 (18). – С. 23-26.
- Анохин В. А. Ацетонемический синдром при острых кишечных инфекциях у детей / В. А. Анохин, С. В. Халиуллина, И. А. Гутор // Детские инфекции. – 2012. – Т. 11. – №. 1. – С. 6-12.
- Леженко Г. А. Место пробиотиков в терапии и профилактике возникновения вторичного ацетонемического синдрома / Г. А. Леженко, Е. Е. Пашкова // Здоровье ребенка. – 2015. – №. 3 (63). – С. 31-34.
- Одинец Т.Н. Состояние антиэндотоксинового иммунитета и метаболической интоксикации при острых кишечных инфекциях / Т.Н. Одинец, И.З. Каримов, Д.К. Шмойлов [и др.] // Актуальная инфектология – 2014. – №2 (3). – С. 27-29.
- Маржохова М. Ю. Некоторые показатели синдрома интоксикации при острых кишечных инфекциях / М. Ю. Маржохова, М. А. Башиева, Ж. М. Желихажева // Эпидемиология и инфекционные болезни. – 2008. − № 6. – С. 39-42.
- Лурин И.А., Сотников А.В., «Микробный пейзаж и чувствительность к антибиотикам возбудителей анаэробных неклостридиальные флегмоны таза» // Таврический МЕДИКО-БИОЛОГИЧЕСКИЙ ВЕСТНИК 2011, том 14, №4 ч.1 (56)
- ІНСТРУКЦІЯ для застосування препарату ЕНТЕРОКЛІН®, ТУ У 10.8-38405950-005:2016.
- Крамарєв С.О., Дмітрієва О.А., Національний медичний університет імені О.О. Богомольця, м. Київ, «ЕНТЕРОСОРБЦІЯ ПРИ ГОСТРИХ КИШКОВИХ ІНФЕКЦІЯХ У ДІТЕЙ» // ЖУРНАЛ “ЗДОРОВ`Я ДИТИНИ” 2 (29) 2011
Журнал «Клінічна імунологія. Алергологія. Інфектологія» № 5 (118) ‘ 2019, стор.42-45.
